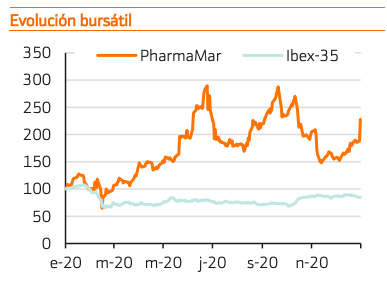
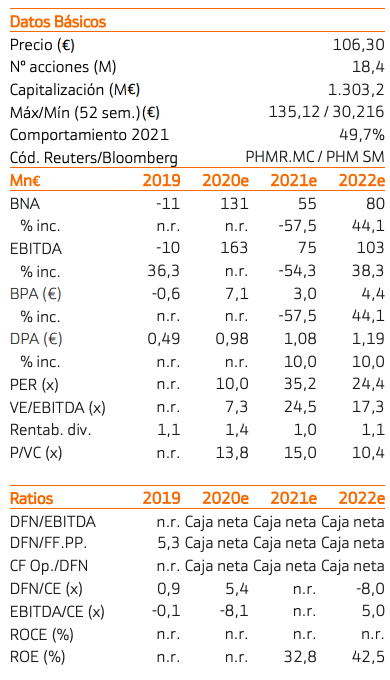
Tras la decepción de los resultados del estudio Atlantis de Zepzelca combinado con doxorrubicina, PharmaMar sorprende positivamente al anunciar varias universidades de reconocido prestigio la efectividad de Aplidina como tratamiento para pacientes de COVID-19.
La revista Science confirma la efectividad de Aplidina para tratar el COVID-19
Es un importante paso en el proceso de aprobación de Aplidina (Plitidepsina) como tratamiento contra el COVID-19 tras los resultados positivos del ensayo APLICOV que conocimos en noviembre 2020. La compañía publica en la revista científica Science el artículo “Plitidepsina tiene una potente eficacia preclínica contra el SARS-CoV-2 al dirigirse a la proteína del huésped eEF1A”. Según este, los experimentos in vitro e in vivo muestran una eficacia antiviral y un perfil de toxicidad prometedores y una reducción de la replicación viral, con una disminución del 99% de las cargas virales en el pulmón de los animales tratados.
Los autores concluyen que plitidepsina es con diferencia, el compuesto más potente y debería probarse en ensayos clínicos. La publicación de este artículo es fruto de una colaboración entre Pharma Mar y científicos de la Icahn School of Medicine, el Instituto de Biociencias Cuantitativas de la Universidad de California San Francisco, y el Instituto Pasteur de París. Posiblemente, lo más importante es que la opinión de varias universidades de reconocido prestigio confirma la validez de Aplidina como tratamiento para pacientes de COVID-19.
El siguiente paso es iniciar ensayos de fase III
Los ensayos confirman la eficacia de Aplidina. Pharma Mar está negociando con diferentes organismos reguladores el inicio de los ensayos clínicos de fase III necesarios para continuar con el proceso de aprobación de este medicamento como tratamiento para pacientes de COVID-19. El plazo es una incógnita, como referencia, el desarrollo y aprobación de las vacunas COVID-19 ha durado aproximadamente nueve meses.
Recomendación sobre las acciones de PharmaMar
Ajustamos nuestras estimaciones y valoración para incorporar el efecto positivo de este tratamiento que damos una probabilidad de aprobación del 80% (anterior 60%) y elevamos su efecto en nuestra valoración a 43,50 €/acción. Otros aspecto positivo es el proceso de aprobación definitiva de Zepzelca en EE.UU. sobre el que esperamos novedades en la recta final de 2021 o 2022. Nuestro nuevo Precio Objetivo es 125 €/acción (anterior 90 €/acción). Elevamos nuestra recomendación a Comprar desde Neutral.
Por Departamento de Análisis Bankinter
Los informes disponibles para su descarga y los artículos del Blog de Bankinter se realizan con la finalidad de proporcionar a sus lectores información general a la fecha de emisión de los mismos. La información se proporciona basándose en fuentes consideradas como fiables, si bien ni Bankinter ni el Blog garantizan la seguridad de las mismas. Los informes del departamento de Análisis de Bankinter, S.A. reflejan tan sólo la opinión del departamento, y están sujetas a cambio sin previo aviso.El contenido de los artículos no constituye una oferta o recomendación de compra o venta de instrumentos financieros. El inversor debe ser consciente de que los valores e instrumentos financieros a que se refieren pueden no ser adecuados a sus objetivos concretos de inversión, por lo que el inversor debe adoptar sus propias decisiones de inversión, procurándose a tal fin el asesoramiento especializado que considere necesario. Por favor, consulte importantes advertencias legales.