Almirall, S.A. (ALM.MC), en cumplimiento de lo dispuesto en el artículo 228 del Real Decreto Legislativo 4/2015, de 23 de octubre, por el que se aprueba el Texto Refundido de la Ley del Mercado de Valores, anuncia que:
Almirall y Sun Pharmaceutical Industries Ltd. firman un acuerdo de licencia para el desarrollo y la comercialización de tildrakizumab para psoriasis en Europa. Tildrakizumab es un inhibidor IL- 23p19 en fase de investigación que actualmente está siendo evaluado en pacientes con psoriasis en placa, de moderada a severa.
Según los términos del acuerdo de licencia, Almirall realizará un pago inicial a Sun Pharma de $50 millones. Tildrakizumab ha completado recientemente los estudios de fase 3. Sun Pharma tendrá derecho a recibir pagos por hitos regulatorios, de desarrollo y de ventas, así como royalties por ventas netas, cuyos términos son confidenciales.
Almirall podrá liderar los estudios europeos y participar en estudios clínicos globales más extensos para la indicación de psoriasis, sujetos a los términos del acuerdo entre Sun Pharma y Merck, así como a ciertos acuerdos de costes compartidos. Sun Pharma continuará liderando el desarrollo de tildrakizumab para otras indicaciones, donde Almirall será el primero en tener derecho a negociación para ciertas indicaciones en Europa.
Resultados del ensayo de fase 3 de tildrakizumab
En mayo de 2016, los dos ensayos clínicos pivotales de fase 3 de tildrakizumab cumplieron los objetivos primarios para ambas dosis evaluadas. Los resultados preliminares se comunicaron en nota de prensa separada. Los criterios de valoración principales de eficacia fueron: la proporción de participantes con psoriasis que alcanzaron PASI 75 (Psoriasis Area Sensitivity Index 75) en la semana 12, en comparación con placebo; y la proporción de participantes con una puntuación PGA (Physician’s Global Assessment) de blanqueamiento (PGA=0) o mínima con al menos una reducción de 2 grados desde el momento inicial hasta la semana 12, en comparación con placebo. El perfil de seguridad global de tildrakizumab en ambos ensayos clínicos de fase 3 fue consistente con los datos de seguridad observados en los estudios previamente comunicados. Además, en el segundo estudio se incluyó un brazo comparativo con etanercept con un objetivo secundario clave en el que se comparaban tildrakizumab y etanercept en PASI 75 y PGA. Tildrakizumab 200 mg fue superior a etanercept tanto en el índice PASI 75 como en el PGA en la semana 12, mientras que la dosis de 100 mg mostró superioridad frente a etanercept sólo en PASI 75.
Sobre Tildrakizumab
Tildrakizumab es un anticuerpo monoclonal humanizado anti-IL-23p19 en investigación, diseñado para bloquear selectivamente la citocina IL-23. Las evidencias de estudios genéticos en humanos sugieren que la inhibición de IL-23 podría proporcionar un enfoque de tratamiento en ciertas condiciones inflamatorias.
https://www.cnmv.es/Portal/HR/ResultadoBusquedaHR.aspx?nreg=241357&th=H
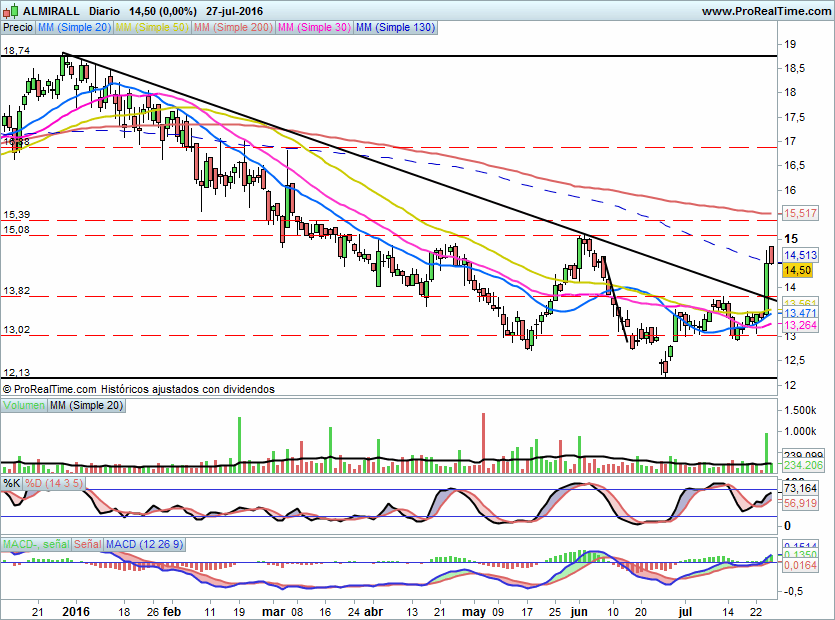
La noticia ha salido publicada después del cierre del mercado y NO esta recogida aun en el precio.
A corto plazo el valor esta consolidando la fuerte subida anterior, la resistencia sigue estando en 15,08€, una resistencia clave si se quiere pensar en un nuevo impulso alcista que por lo menos no lleve hacia la zona de los 16,90€
Gesprobolsa
Estos informes responden a la opinión subjetiva de los analistas de bolsa, a quienes no puede imputarse responsabilidad alguna por las operaciones realizadas en función de estas recomendaciones. Queda expresamente prohibida la reproducción total o parcial de este documento o de su contenido sin el permiso expreso de bolsa. Para cualquier solicitud, sugerencia o petición deben dirigirse a gesprobolsa@gmail.com