PharmaMar comunica resultados positivos en el ensayo de registro de Aplidin® en pacientes con mieloma múltiple
· PharmaMar presentará solicitud de autorización de comercialización a la Agencia Europea del Medicamento (EMA) en el último trimestre de este año
Madrid, 31 de marzo, 2016 – PharmaMar (MSE:PHM) ha anunciado hoy resultados positivos del ensayo clínico de Fase III conocido como ADMYRE que evalúa Aplidin® (plitidepsina) en combinación con dexametasona versus dexametasona en pacientes con mieloma múltiple en recaída o refractario, el cual ha demostrado una reducción del riesgo de progresión o muerte estadísticamente significativo del 35% sobre el comparador (p=0.0054), cumpliendo así con el objetivo primario del estudio.
ADMYRE es un ensayo clínico pivotal, randomizado, abierto, internacional, multicéntrico de fase III que incluyó a 255 pacientes en 83 centros médicos de 19 países (incluidos Estados Unidos, Europa y Asia-Pacífico) con mieloma múltiple que han recaído después de haber recibido previamente al menos tres regímenes terapéuticos, pero no más de seis.
El estudio ha analizado la eficacia de plitidepsina en combinación con dexametasona versus dexametasona comparando la supervivencia libre de progresión calculada a partir del criterio establecido por el International Myeloma Working Group (IMWG). También evalúa otros objetivos secundarios de eficacia. Los datos finales del ADMYRE se presentarán en una reunión científica.
“Teniendo en cuenta que los resultados son positivos, nuestra intención es presentar una solicitud de autorización de comercialización a la Agencia Europea del Medicamento (EMA) en el último trimestre de este año”, apunta Luis Mora, Director General de la Unidad de Oncología de PharmaMar, quien añade que “me gustaría dar las gracias a los pacientes, doctores y al equipo de PharmaMar que han contribuido al éxito de este ensayo. Aplidin® podría ser nuestro segundo compuesto de origen marino aprobado en el mercado”.
Como ya se anunció, PharmaMar mantiene varios acuerdos de licencia para la comercialización y distribución de Aplidin® con Specialised Therapeutics Asia en el sudeste asiático, Australia y Nueva Zelanda; con TTY Biopharm en Taiwán; así como un acuerdo de copromoción para 8 países europeos con Chugai Pharma Europe.
Sobre mieloma múltiple
El mieloma múltiple es un tipo relativamente raro de cáncer de la sangre. Representa el 10% de todas las neoplasias hematológicas malignas y está causado por células plasmáticas malignas que se multiplican rápidamentei . Las células plasmáticas normales son células blancas sanguíneas que forman parte del sistema inmune, se encuentran en la médula ósea y se encargan de producir los anticuerpos necesarios para combatir infeccionesii. Las células anormales producen un tipo de anticuerpo anómalo que se acumula en el organismo, impidiendo un correcto desarrollo de las células normales. Casi todos los pacientes con mieloma múltiple sufren un progreso de la enfermedad desde una etapa inicial asintomática hasta una etapa en la que la enfermedad se ha establecido. En 2015 se diagnosticaron 26.850 nuevos casos en los EE.UU., y cerca de 11.200 personas murieron a causa de esta enfermedad iii . En Europa, la incidencia es de 4,5 a 6 casos diagnosticados por 100.000 habitantes y añoiv
. Sobre APLIDIN® (plitidepsina)
Plitidepsina es un medicamento antitumoral de origen marino en fase de investigación obtenido de la ascidia Aplidium albicans. Es un first-in-class que se dirige específicamente al factor eEF1A2 en las células tumorales. Plitidepsina se encuentra actualmente en desarrollo clínico para tumores hematológicos, incluyendo este estudio de Fase III en mieloma múltiple en recaída o refractario, un ensayo de Fase Ib en mieloma múltiple en recaída o refractario con triple combinación de tratamiento con plitidepsina, bortezomib y dexametasona y un estudio de Fase II en linfoma de células T angioinmunoblástico en recaída o refractario. Plitidepsina ha recibido designación de fármaco huérfano por la Agencia Europea de Medicamentos (EMA) y la Food and Drug Administration (FDA).
http://www.cnmv.es/Portal/HR/ResultadoBusquedaHR.aspx?nreg=236798&th=H
Noticia positiva que supondría un nuevo producto en mercado ,esto significaría incremento de ventas y EBITDA para la compañía.
Si tenemos en cuenta que en 2015 consiguió los mejores resultados de su historia y que cotiza a unos 2,5€, pues obviamente esta barata, vale menos que al cierre del año 2014 que fue 2,67€.
Es sencillo saber que la aprobación de Aplidin NO esta recogida en el precio.
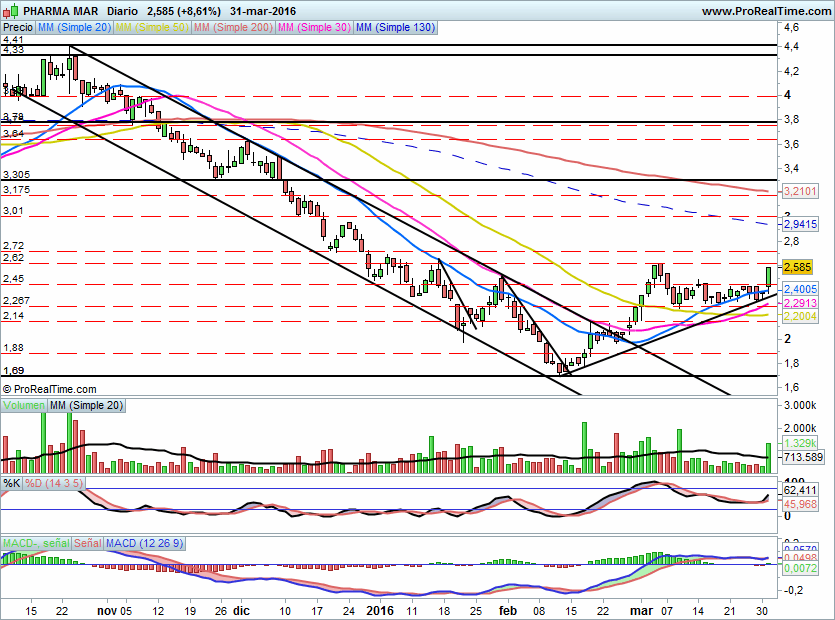
Por técnico ha roto 2,45€ y se enfrenta ahora a la resistencia de 2,62-2,72€
Pues bien, el grafico es claro , ruptura con incremento de volumen de la resistencia de 2,45€, apoyada además por la noticia positiva de los resultados positivos con Aplidin.
Ahora mismo solo queda la resistencia de 2,62€ y mas arriba 2,72€, incluso si hay suerte y el tramo es equiparable al anterior podría llegar rápido a los 3,00€.
Por abajo esta claro que la zona de soporte pasa a ser ahora mismo el 2,44€, anterior resistencia que ahora debe funcionar como soporte.
El MACD ha cruzado al alza y el estocástico marca compra.
Gesprobolsa
Estos informes responden a la opinión subjetiva de los analistas de bolsa, a quienes no puede imputarse responsabilidad alguna por las operaciones realizadas en función de estas recomendaciones. Queda expresamente prohibida la reproducción total o parcial de este documento o de su contenido sin el permiso expreso de bolsa. Para cualquier solicitud, sugerencia o petición deben dirigirse a gesprobolsa@gmail.com