El ensayo de Fase III con PM1183 en cáncer de ovario (CORAIL) continúa de acuerdo con la recomendación positiva del IDMC
Madrid, 8 de febrero de 2016 – PharmaMar (MSE:PHM) ha anunciado hoy que el Comité Independiente de Monitorización de Datos (IDMC por sus siglas en inglés) ha notificado a la Compañía que recomienda continuar sin cambios el ensayo de Fase III (CORAIL) actualmente en curso con PM1183 en pacientes con cáncer de ovario resistente al platino.
La recomendación del IDMC viene tras el análisis de los datos de seguridad obtenidos de los 80 primeros pacientes tratados en el estudio. El ensayo de Fase III pivotal randomizado evalúa la eficacia de PM1183 comparada con el tratamiento estándar en esta indicación: topotecan o doxorrubicina liposomal pegilada en un total de 420 pacientes.
Sobre PM1183 (lurbinectedina)
PM1183 es un compuesto en investigación clínica que pertenece a los inhibidores de la enzima ARN polimerasa II, la cual es esencial para el proceso de transcripción. Por medio de la inhibición de la transcripción, el compuesto reduce la expresión de ciertos factores que están involucrados en la progresión del tumor y bloquea el sistema de reparación del ADN denominado NER. Esto finalmente induce la muerte de las células tumorales. La eficacia antitumoral de PM1183 (lurbinectedina) se está investigando en varios tipos de tumores, incluidos un estudio de fase III en cáncer de ovario resistente a platino, un ensayo de fase II en cáncer de mama asociado a BRCA1/2, y un estudio de fase Ib en cáncer microcítico de pulmón.
Sobre el cáncer de ovario
El cáncer de ovario es el segundo más común y el que más muertes produce dentro de los tumores ginecológicos. Se estima que se diagnosticarán en todo el mundo unos 240.000 casos nuevos de cáncer de ovario al año, y unas 150.000 mujeres morirán debido a esta enfermedadi . La mayoría de las pacientes se diagnostican en un estadio avanzado de la enfermedad, donde el tumor se ha diseminadoii . El tratamiento consiste en extirpar el tumor primario y reducir con cirugía el tumor visible, seguido de quimioterapia. El 80% de las pacientes de cáncer de ovario recaen después del tratamiento con un derivado del platino o del taxol, y por tanto podrían beneficiarse de otros fármacosiii
. Sobre PharmaMar
PharmaMar es una compañía biofarmacéutica con sede en Madrid, líder mundial en el descubrimiento, desarrollo y comercialización de nuevos antitumorales de origen marino. PharmaMar tiene una importante cartera preclínica de compuestos y un potente programa de I+D. La compañía desarrolla y comercializa YONDELIS® en Europa y dispone de otros tres compuestos en desarrollo clínico para tumores sólidos y hematológicos: plitidepsina, PM1183 y PM184. PharmaMar es una compañía biofarmacéutica global con presencia en Alemania, Italia, Francia, Suiza, Reino Unido, Bélgica y EE.UU.
PharmaMar también tiene la participación mayoritaria de otras compañías: GENOMICA, primera empresa española en el campo del diagnóstico molecular; Sylentis, dedicada a la investigación de las aplicaciones terapéuticas del silenciamiento génico (RNAi), y dos empresas del sector químico, Zelnova Zeltia y Xylazel. Para más información, visite nuestra web: www.pharmamar.com
http://www.pharmamar.com/wp-content/uploads/2016/02/NdP_Recomendacion-positiva-IDMC.pdf
Esta noticia se le une a la comunicada hace unos días:
PharmaMar y Specialised Therapeutics Asia firman un acuerdo de licencia y comercialización para APLIDIN® (plitidepsina) para varios países de Asia
https://www.pharmamar.com/es/sala-de-prensa/notas-de-prensa/
Un resultado positivo en un ensayo en FASE III es muy interesante, es la ultima fase que debe pasar un producto antes de su aprobación y que supone a posteriori su comercialización , lo que en definitiva implica que de seguir así las cosas pronto podría ser un nuevo producto en mercado.
Es posible que Pharmamar a 4,40€ estuviera cara pues capitalizaba cerca de 1000 millones de €, pero ahora mismo solo vale 444 millones de €.
Esta cifra no recoge la aprobación de YONDELIS en EEUU y JAPON entre septiembre/octubre del pasado año ,recogemos la opinión de los expertos por aquellas fechas.
Yondelis, proveniente originalmente de una ascidia marina, se comercializa en 78 países. En Europa fue aprobado en 2007 para el tratamiento de sarcoma de tejidos blandos y en 2009 para el cáncer de ovario recurrente. Las ventas netas del fármaco ascendieron en 2014 a 76,8 millones. El analista de Ahorro Corporación detalla que, si se aprueba el medicamento en EE UU, Zeltia recibirá entre el 11,25% y el 19% del total de las ventas en ese país en derechos de licencia o royalties, que debe desembolsar Janssen. Aristegui prevé que el mercado de este tratamiento alcance los 100 millones de euros en ese país, y calcula que los ingresos para Zeltia se situarán en alrededor de 11 y 19 millones que, como royalties, se contabilizan directamente en el ebitda. Pero la compañía espera, además, un efecto rebote del uso de Yondelis en otros países gracias al prestigio de una conformidad de la FDA.
Otras fuentes del mercado calculan que en 2020, año de pico máximo de ventas, en EE UU y Japón alcance los 187 millones en facturación, de los que un 15% en el país asiático irán al ebitda del grupo gallego. Estos ingresos netos se reflejarían rápidamente en las cuentas de la española, ya que en EEUU el comienzo de las ventas es casi automático desde que el medicamento recibe el visto bueno.
http://cincodias.com/cincodias/2015/09/18/empresas/1442607436_162533.html
Y como fue aprobado tanto en EEUU como en JAPON , Pharmamar recibió 20 millones de €.
El impacto en términos de EBITDA de dicha aprobación suponen aproximadamente unos 25 millones de € al año…. Un EBITDA a mayores del que genera actualmente la compañía. ( hasta el 31 de septiembre este EBITDA ascendía a 16,6 millones de €)
https://www.pharmamar.com/wp-content/uploads/2015/11/NdP-Resultados-3Q2015-FINAL1.pdf
Con un EBITDA de 45 millones de € y sin contar otro tipo de aprobaciones como la del estudio actual que esta en fase 3, Pharmamar debería valer unos 675 millones de €, o lo que es lo mismo mas de 3€ por acción.
Una OPA sobre Pharmamar como se ha rumoreado en miles de ocasiones se tendría que ir por encima de los 4€.
Se puede decir que antes de aprobar el YONDELIS en EEUU y JAPON descontaba el precio dicha aprobación y a mayores descontaba otras aprobaciones pendientes que se encontraban en distintas fases de desarrollo, actualmente no recoge ni lo que tiene la empresa.
Unos comunicados como los de estos últimos días como son el acuerdo para comercializar APILDIN en Asia o este estudio en FASE III, en otros tiempos el valor se habría disparado un 20% o mas, pero al mercado le ha dado igual todo….
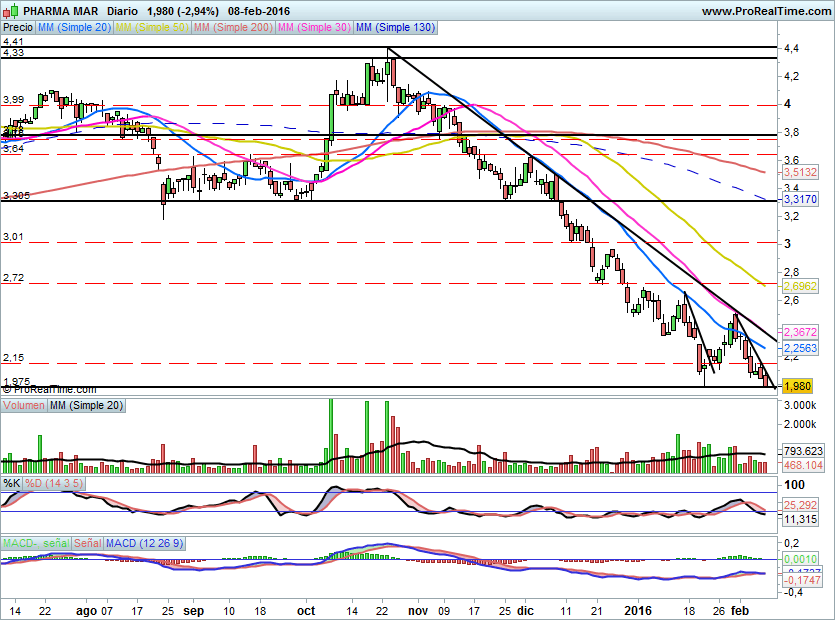
Por técnico
A corto plazo no puede con la ultima directriz acelerada y solo queda que este precio de cierre de la sesión de hoy sirva de doble apoyo para iniciar un nuevo tramo alcista.
Para confirmar el inicio del rebote debe superar 2,15€ y para ser un cambio de tendencia de medio plazo con 1º objetivo 2,72 y 3,00€ debe superar 2,36€.
Las noticias positivas que deberían haber contribuido a la causa, de momento no han servido para nada, mas bien han sido olvidadas o dejadas de lado por el mercado.
Gesprobolsa
Estos informes responden a la opinión subjetiva de los analistas de bolsa, a quienes no puede imputarse responsabilidad alguna por las operaciones realizadas en función de estas recomendaciones. Queda expresamente prohibida la reproducción total o parcial de este documento o de su contenido sin el permiso expreso de bolsa. Para cualquier solicitud, sugerencia o petición deben dirigirse a gesprobolsa@gmail.com